Pesquisador detalha método que causou remissão de tumor terminal
Versão da terapia de reprogramação genética desenvolvida por médicos brasileiros representa inovação no tratamento contra câncer linfático
atualizado
Compartilhar notícia

Nas últimas semanas, a história do funcionário público aposentado Vamberto Luiz de Castro, 63 anos, ganhou atenção do mundo inteiro. Diagnosticado com câncer linfático metastático e terminal, Vamberto foi submetido a uma adaptação brasileira da técnica norte-americana CAR T-Cell e hoje é considerado “virtualmente” curado.
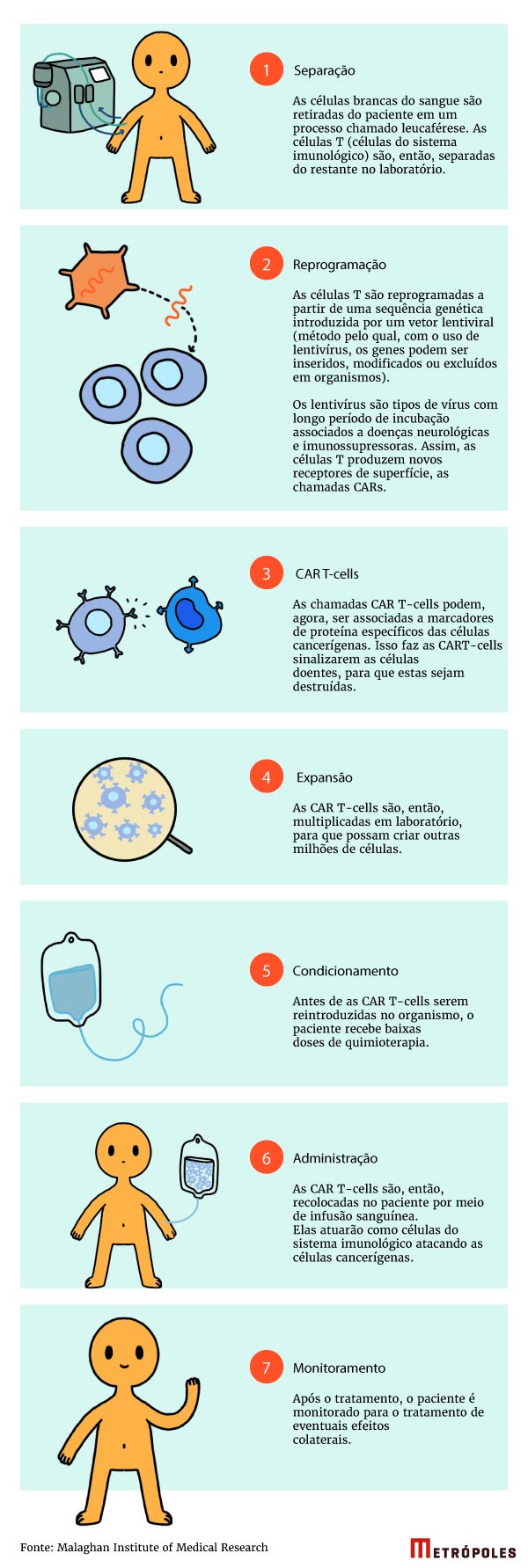
Em linhas gerais, o tratamento retira células de defesa do corpo do paciente e as “reprograma” em laboratório, por meio da infecção de um vírus criado especificamente para esse fim. Uma vez infectadas, as células são capazes de identificar e destruir as células tumorais. Elas são, então, reintroduzidas no paciente.
Eduardo Rego, pesquisador do Centro de Terapia Celular (CTC-Fapesp-USP), coordenador da Hematologia no Grupo Oncologia D’Or e membro da Coordenação da área da Saúde da Fundação de Apoio à Pesquisa do Estado de São Paulo (FAPESP), explicou ao Metrópoles que a técnica vem sendo utilizada em larga escala na China, nos Estados Unidos e países da Europa ocidental. “A primeira vez que tive contato com o método foi em 2005, em congressos sobre tratamentos para leucemia”, relembra.
O projeto brasileiro está sendo desenvolvido pelo Centro de Terapia Celular desde 2001, segundo Eduardo. Embora represente uma revolução no tratamento contra o câncer, o médico explica que, por enquanto, a versão brasileira da técnica é específica para linfoma não Hodgkin (LNH), um tipo de câncer que tem origem nas células do sistema linfático e que se espalha de maneira não ordenada.
Em um futuro próximo, Eduardo Rego diz que a expectativa é que o método consiga tratar também as chamadas doenças linfoproliferativas, que envolvem outras variedades de linfomas. O hematologista afirma, entretanto, que ainda é cedo para dizer quando outros tipos de câncer poderão ser tratados com o método. “O desenvolvimento dessa técnica envolve encontrar uma molécula específica para cada doença, para que a célula modificada destrua apenas as células malignas, e não outros tecidos e órgãos importantes”.
Por enquanto, a técnica ainda apresenta riscos altos. Eduardo Rego detalha que a maioria dos pacientes apresenta um quadro de síndrome de liberação de citocina, uma resposta exagerada do sistema imunológico que produz uma descarga de várias moléculas que podem causar choque circulatório, febre e um estado inflamatório exacerbado.
Os pacientes precisam ser acompanhados dentro de uma unidade de terapia intensiva por uma equipe com experiência em transplante de medula óssea já que, segundo o médico, muitos dos efeitos colaterais são semelhantes aos de pacientes transplantados.
O hematologista destaca que há, ainda, a possibilidade do desenvolvimento de um quadro de problemas neurológicos apresentado por cerca de 10% a 15% dos pacientes submetidos ao CAR T- Cell. “Esse quadro é grave e geralmente leva o paciente ao coma. Ainda estamos entendendo por que ele ocorre e como lidar com ele”, detalha. “É importante salientar esses efeitos adversos para dar uma noção real para os pacientes envolvidos naquela proposta de tratamento.”
Atualmente, a técnica foi aprovada como uso compassivo, isso quer dizer que é um método considerado experimental. “Ele está sendo utilizado em pacientes que não tem nenhuma outra alternativa de tratamento e, portanto, os riscos são baixos diante dos benefícios que esse paciente pode ter”, detalha Eduardo Rego.
Para que a tecnologia esteja disponível tanto na rede pública quanto na rede privada de saúde, ainda é preciso realizar estudos clínicos, compostos por várias etapas. “Esperamos provar que a metodologia é segura e eficaz para obter a autorização dos órgãos reguladores nacionais para passarmos a fase de estudos clínicos”, explica o médico. “Com base nele, poderemos disponibilizar a técnica na rede pública e, eventualmente, na rede privada.” A estimativa, de acordo com o médico, é que esses estudos clínicos possam ser feitos dentro de até três anos, a depender dos resultados e dos investimentos obtidos.
Para 2020, a equipe planeja aplicar a técnica em mais três ou quatro pacientes já selecionados. Não há como se candidatar para o tratamento. “Nosso grupo tem uma capacidade limitada para produzir um número de células suficientes”, justifica o médico. “Temos tentado com agências de fomento e com parceiros mas, por enquanto, precisamos esperar conseguir uma expansão para fazer o escalonamento do método.”